本年度第21回年会(オンライン)における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
YSA-01 小林 稜平(東京大学)

この度は第21回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に思います。審査員の先生方をはじめとする学会関係者の皆様、ならびに本研究を遂行するにあたり助言をいただきました野地研究室の皆様にこの場を借りてお礼を申し上げます。
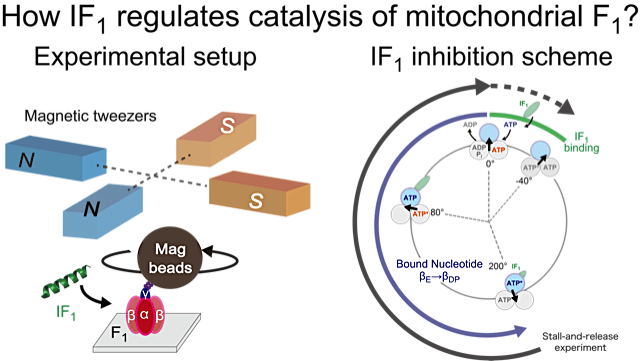
私の研究対象はミトコンドリア型 ATP 合成酵素の制御因子である IF1 というタンパク質です。数々の生化学実験や高分解能結晶構造から阻害機構が提案されてきましたが、詳細な速度論的解析や1分子計測は行われておらず、動的な制御機構については不明でした。私たちは近年立ち上げたミトコンドリア型 F1-ATPase(F1)の1分子回転解析系を用いて IF1 の制御機構を解明しようと試みました。
実験を進めると、IF1 阻害状態に陥った F1 は自発的に回転再開しないことが分かりました。これは、1回の実験でたった1粒子、1データしか取れないことを意味します。研究が始まった当初は「しんどい実験が続くなあ」と辟易としたものでした。私たちは、顕微鏡上に磁気ピンセットと呼ばれる電磁石対を設置し、F1 の回転を外部から制御できるようにしました。その結果、ある特定の条件下で実験を行うと IF1 阻害状態から解放されて F1 の回転が復活することが分かり、同一 F1 粒子での繰り返し実験が可能になりました。また、回転再開割合は操作条件に強く依存しており、F1 自身の触媒反応との共役した F1 阻害機構が明らかになってきました。今後は本研究の知見を生かして、さらに F1 の動的な制御機構に迫る研究を続けていきたいと思います。
YSA-02 森脇 由隆(東京大学)

この度は2021年度の若手奨励賞を賜りまして大変ありがたく存じます。日本蛋白質科学会年会には私が修士課程の学生だった2010年の第10回から参加しており、最も思い入れの大きな学会の1つです。2013年にはポスター賞を頂いておりましたが、これに続く形で本奨励賞をいただけたことはこれからの一層の励みとなります。受賞のきっかけとなった本研究課題において、私はタンパク質のアミノ酸配列からの de novo 構造予測手法およびドッキング手法などを用いてアブラナ科の自家不和合性の分子機構を包括的に解析いたしました。自家不和合性という有名な生命現象の解明に対して私の計算技術が貢献できたことについて、きっかけをくださいました共著者の皆様にはこの場を借りて篤く感謝申し上げます。
私はかつて結晶構造解析と各種の生化学的実験を通じてタンパク質の構造–機能相関の重要性を学びました。博士課程から現在にかけてはタンパク質の MD シミュレーションと QM/MM 法、さらにはディープラーニングを用いたタンパク質立体構造予測手法を学びながら、微生物や植物の持つ稀少なタンパク質の発見や機能解析を行っております。微生物・植物が生み出す多様な代謝物や制御機構の中にはヒトの生活への関わりが深いものも多いですが、タンパク質構造解析が困難であることも多いために、分野によっては分子レベルでの考察が困難なことが長らく続いていることもあります。私のこれまでの経験がこのような農学上の重要な未解決問題の解明に貢献できるよう、これからも精進して参ります。
YSA-03 富田 篤弘(東京大学)

この度は第21回年会におきまして日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。現地開催は中止となってしまいましたが、代わりに web 開催という形で発表の機会を設けて頂き、ありがとうございました。オンラインでの表彰式という、人生で経験するとは思わなかった貴重な体験をさせていただき思い出に残る学会となりました。
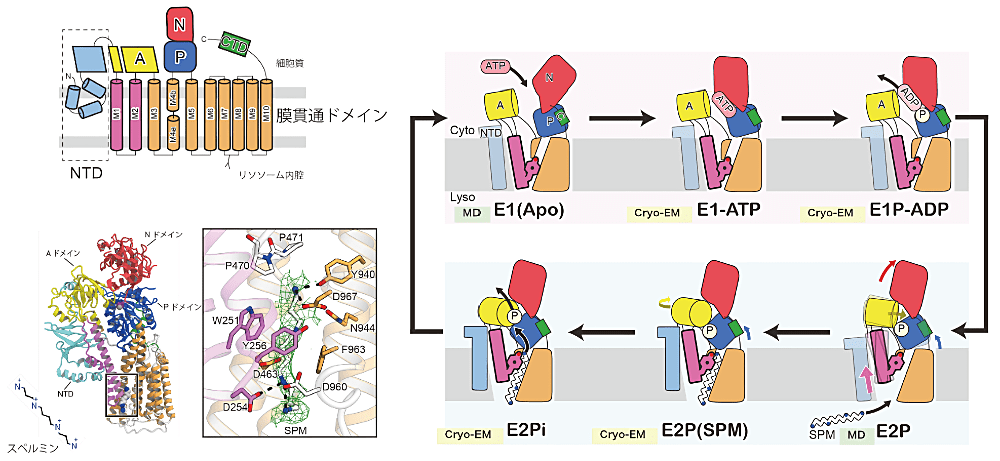
本研究では、多くの生命現象に必須なポリアミンであるスペルミンを輸送する ATP13A2 の立体構造を、クライオ電子顕微鏡を用いた単粒子解析によって決定しました。さらに立体構造に基づいた生化学的解析および分子動力学シミュレーションから、ATP13A2 によるスペルミン認識機構および輸送機構を明らかにしました。
スペルミンは転写の活性化や有毒な物質からの細胞の保護をはじめとする多くの生命現象に必須なポリアミンです。P 型 ATPase ファミリーに属する ATP13A2 はパーキンソン病の原因遺伝子として古くから知られており、リソソーム取り込まれたスペルミンを細胞内に取り込む機能を担っていることが2020年に報告されました。これまでに立体構造が報告された P 型 ATPase は、金属イオンなどの小さなイオンや、脂質のように疎水性の分子を基質とするものであり、スペルミンのように大きなイオン性の分子とは大きく異なっていました。そのため、ATP13A2 によるスペルミン認識機構および輸送機構は不明なままでした。
今回クライオ電子顕微鏡を用いてヒト由来の ATP13A2 について、スペルミン結合状態を含む4状態での構造決定に成功しました。スペルミン結合状態の構造から、ATP13A2 が既存の P 型 ATPase とは異なり大きなトンネル状の基質結合部位を形成していることが明らかになりました。さらに、得られた4状態の構造とMDシミュレーションを組み合わせることで、ATP13A2 によるスペルミン輸送サイクルを明らかにすることに成功しました。その結果、膜貫通ヘリックス(M1-2, 紫で図示)の大きな構造変化がスペルミン結合部位の形成に必須であること、およびスペルミンがフレキシブルな中間状態を安定化して輸送サイクルを促進していることが明らかになりました。
本研究を行うにあたりご指導いただいた濡木教授、西澤教授、大保博士をはじめとする共同研究者の方々に心より感謝申し上げます。今後も楽しいことを見つけ・考えてこれからの研究生活も邁進していきたいと思います。
YSA-04 島田 寛人(東京大学)

この度は若手奨励賞をいただき、大変光栄に存じます。
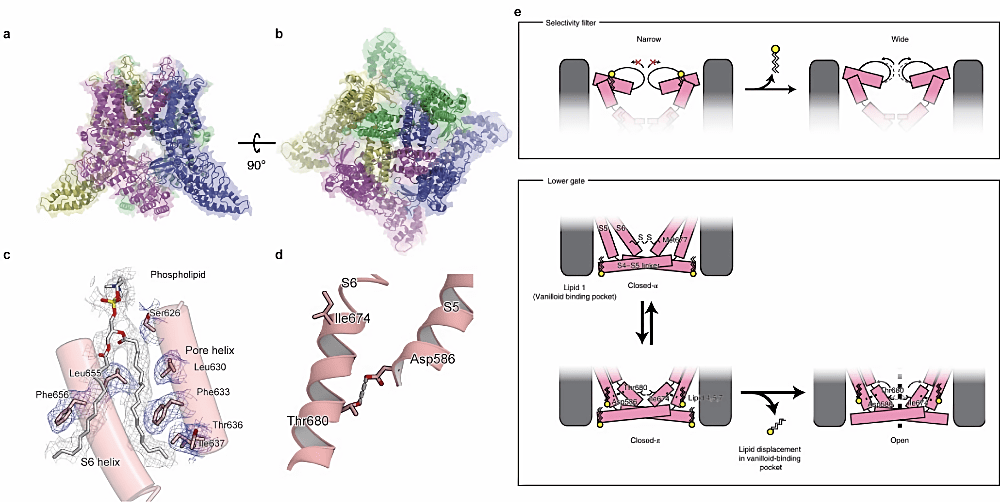
温度センサーである TRPV3 は、脂質の活性化機構への関与が電気生理学的研究から示唆されていました。しかしながら、先行の TRPV3 の構造解析において脂質の関与する機構は不明であり、脂質中の TRPV3 の構造が求められていました。そこで本研究では TRPV3 を脂質二重層である Nanodisc に再構成し、クライオ電子顕微鏡を用いて 3.3 Å の分解能で構造解析いたしました。構造から、脂質の結合が TRPV3 のイオン選択性フィルターを狭窄させること、また、脂質二重層ではゲートがこれまでの構造解析とは異なる状態の閉状態であることが明らかとなりました。それらの知見から、新たに TRPV3 が脂質分子により活性化を制御されるとする活性化モデルを提唱いたしました。
本研究を行うにあたりご指導いただいた濡木 理教授、草木迫 司助教、西澤 知宏助教(現横浜市立大学教授)、をはじめとする濡木研究室の方々、及び日野 智也講師(鳥取大学)、富永 真琴教授(生理学研究所)をはじめとする共同研究者の方々に心より感謝申し上げます。本当にありがとうございました。
YSA-07 武田 聖(東京大学)

この度は第21回年会におきまして日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。現地開催は中止となってしまいましたが、代わりに web 開催という形で発表の機会を設けて頂き、ありがとうございました。
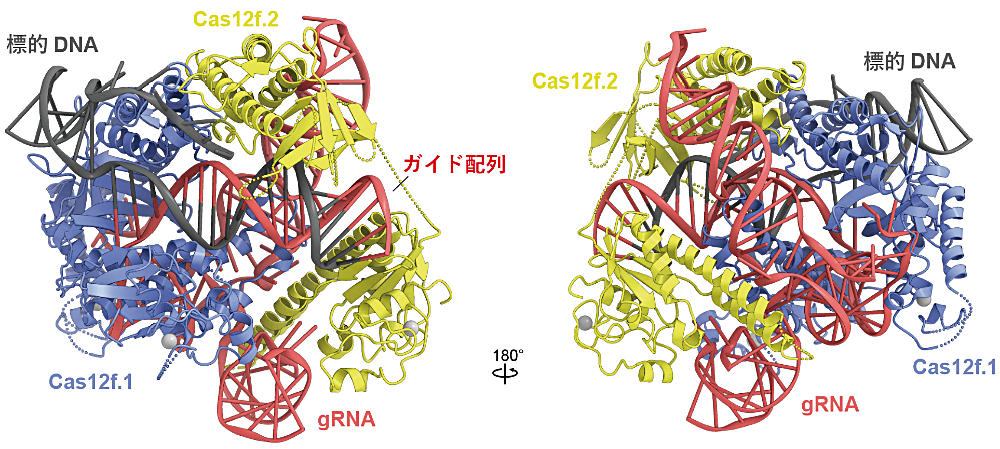
本研究では、ゲノム編集への応用が期待される Cas12f の立体構造を、クライオ電子顕微鏡を用いた単粒子解析によって決定しました。さらに立体構造を基にした生化学的解析から Cas12f による標的DNA切断メカニズムの一端を解明しました。
ゲノム編集は、「生命の設計図」であるゲノム情報(DNA の塩基配列)を人為的に改変する革新技術であり、遺伝子治療や創薬、バイオ燃料の開発や農作物の品種改良、遺伝子改変生物を用いた基礎研究などさまざまな領域において広く利用されています。ゲノム編集には Cas9 とよばれる CRISPR-Cas 酵素が広く利用されていますが、分子のサイズが大きいため細胞への導入効率が低いなどの問題点が残されています。一方、近年発見された Cas12f は Cas9 の半分以下の分子サイズにも関わらず、Cas9 と同様にガイド RNA(gRNA)と結合し標的 DNA を切断するはたらきをもちます。したがって、Cas12f は小型のゲノム編集ツールとして期待されていますが、Cas12f がはたらく仕組みは不明でした。
今回、クライオ電子顕微鏡を用いて Cas12f–gRNA–標的DNA複合体の立体構造を決定することに成功しました。その結果、予想外なことに、2つの Cas12f 分子(Cas12f.1 と Cas12f.2 と命名)が1つの gRNA 分子に結合し、標的 DNA を認識することが明らかになりました。生化学的解析からも、構造も機能も異なる2つの Cas12f 分子が「非対称二量体」を形成して、標的 DNA を切断していることが明らかになりました。これらの成果は、多様な CRISPR-Cas 酵素のさらなる理解、および、小型で効率的なゲノム編集ツールの開発につながることが期待されます。
本研究を行うにあたりご指導いただいた濡木教授をはじめとする濡木研究室の方々、及び西増教授をはじめとする共同研究者の方々に心より感謝申し上げます。